كشف باحثون أستراليون عن آلية بيولوجية جديدة، تسهم في توضيح كيف تتشكل الأوعية الدموية الرئيسية للقلب خلال المراحل المبكرة من النمو، وكيف يمكن أن تؤدي أي خلل في هذه العملية إلى عيوب قلبية خلقية خطيرة.
أظهرت الدراسة، التي قادها علماء من جامعة أديلايد، أن مجموعة محددة من الخلايا تُعرف باسم الخلايا العرفية العصبية تلعب دورًا غير معروف سابقًا في تنظيم تطور القلب، من خلال إدارة إشارة نمو أساسية بدقة.
نتائج البحث، التي نُشرت في مجلة Nature Communications، تقدم فهما أعمق لأصل بعض أمراض القلب الخلقية، مثل رباعية فالو، التي تُعد من الأكثر شيوعًا.
انتشار أمراض القلب الخلقية
تؤثر أمراض القلب الخلقية على نحو رضيع واحد من كل 100 مولود حول العالم، حيث تحدث هذه الحالات عندما لا يتكون مجرى تدفق الدم من القلب—وهو الجزء المسؤول عن توجيه الدم إلى الجسم والرئتين—بشكل صحيح خلال الأسابيع الأولى من الحمل.
كيف توجه الخلايا العرفية العصبية نمو القلب؟
أثبتت الدراسة الجديدة أن الخلايا العرفية العصبية تعمل كمنظّمات جزيئية دقيقة، تضمن أن تتطور الخلايا السلفية لعضلة القلب في التوقيت والمكان المناسبين، وأشارت الدكتورة صوفي ويزنياك، الباحثة الرئيسية من مركز بيولوجيا السرطان بجامعة أديلايد، إلى أن “تطور القلب عملية بالغة الدقة، يجب أن تبقى الخلايا في حالة مرنة وغير ناضجة ما يكفي ليكبر القلب بشكل سليم، ثم تبدأ عملية تكوين العضلات في اللحظة المناسبة تماما، وما اكتشفناه هو طريقة جديدة لضبط هذا التوازن”.
بروتين NEDD4 ودوره في ضبط إشارات النمو
يرتكز هذا الاكتشاف على بروتين يُسمى NEDD4، الذي يعمل داخل الخلايا كأنه مسؤول عن مراقبة الجودة، حيث يحافظ على مستويات بروتين آخر يُعرف باسم DKK1 ضمن نطاق محدد، ويؤدي DKK1 دورًا مثبطًا لمسار تطوري مهم يسمى إشارات Wnt، وهو ضروري للحفاظ على الخلايا السلفية للقلب في حالة غير متمايزة وجاهزة للنمو، ووجد الباحثون أن الخلايا العرفية العصبية تُعد مصدرًا رئيسيًا لبروتين DKK1 بالقرب من القلب النامي، ومن خلال التحكم في كميته، تستطيع هذه الخلايا تعديل إشارات Wnt في الخلايا المجاورة، مما يسمح لمجرى تدفق الدم بالتمدد والاصطفاف بشكل صحيح.
ماذا يحدث عند تعطل هذا النظام؟
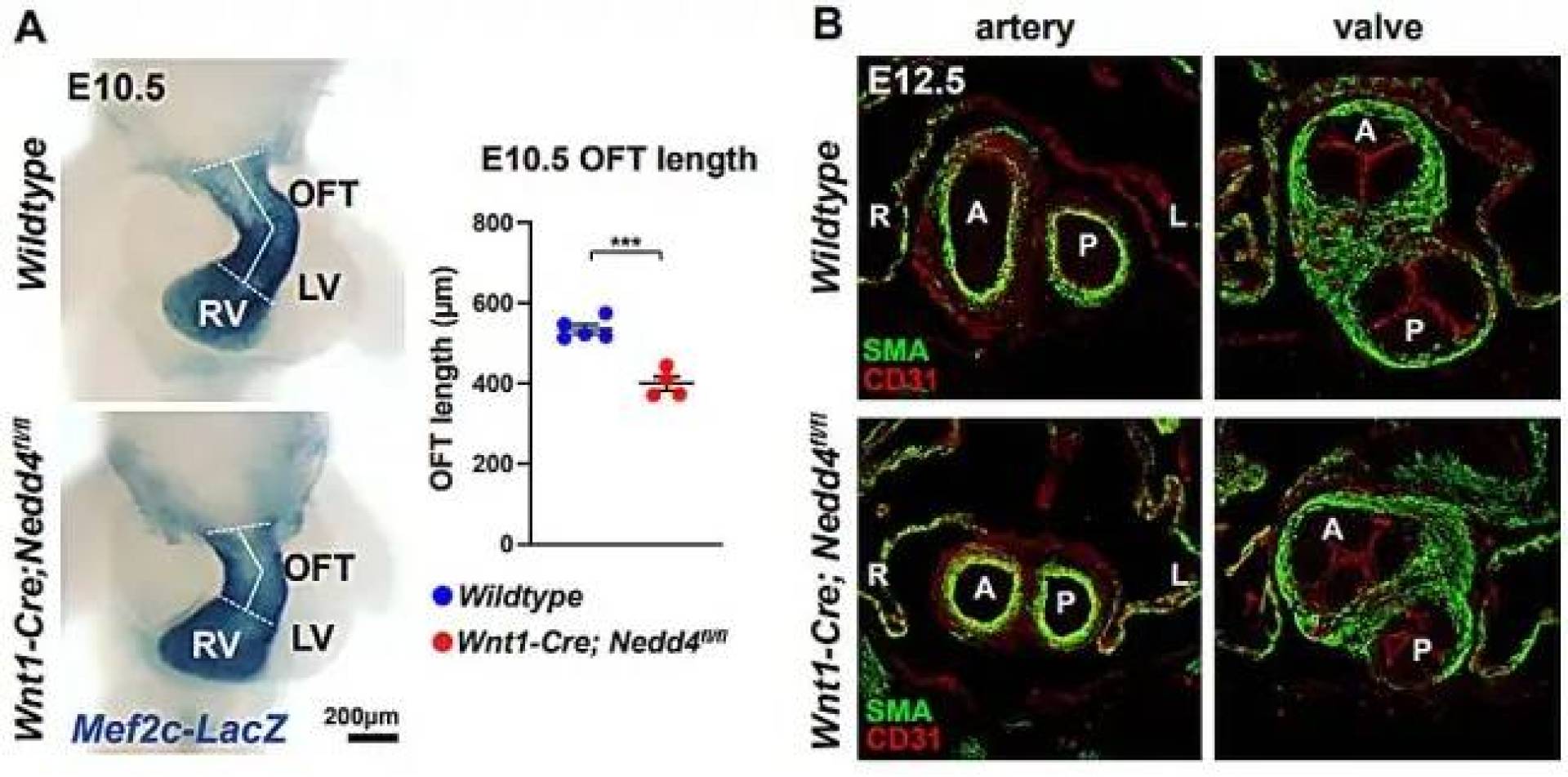
عندما لا يعمل بروتين NEDD4 بشكل سليم، ترتفع مستويات DKK1 بصورة مفرطة، مما يؤدي إلى إيقاف إشارات Wnt مبكرًا، وبالتالي تتحول الخلايا السلفية إلى خلايا عضلية في وقت مبكر جدًّا، مما ينتج عنه قِصر في مجرى تدفق الدم وعدم انتظامه—وهي سمة شائعة في عدة عيوب قلبية خطيرة، وقد أظهر فريق البحث من خلال نماذج فئران معدلة وراثيًا أن إزالة NEDD4 من الخلايا العرفية العصبية تسببت في عيوب مشابهة لتلك التي تظهر لدى الأطفال المصابين، كما أن تقليل مستويات DKK1 ساعد جزئيًا في استعادة النمو الطبيعي للقلب، ما يؤكد دوره المحوري في هذه العملية.
ارتباط مباشر بالأمراض لدى البشر
قدّمت الدراسة أيضًا دليلاً قوياً يربط هذا المسار الجزيئي بأمراض القلب لدى الإنسان، حيث تمكن الباحثون من تحديد متغير وراثي نادر في جين NEDD4 لطفل مصاب برباعية فالو، وأظهرت الاختبارات المعملية أن هذا المتغير يقلل قدرة NEDD4 على التحكم في DKK1، بينما طوّرت الفئران التي حُمّلت الطفرة الجينية نفسها تشوهات قلبية مماثلة لتلك التي تُلاحظ لدى المرضى.
دلالات مهمة للتشخيص والرعاية المستقبلية
قال الأستاذ كوينتن شوارتز، الباحث الرئيسي في الدراسة: “يمثل هذا البحث مثالا واضحا على كيف يمكن لعلم الأحياء التطوري الأساسي أن يعزز فهمنا المباشر للأمراض البشرية، فمن خلال تحديد المسار الجزيئي المسؤول، أصبح لدينا تصور أوضح لكيفية نشوء بعض عيوب القلب الخلقية”، ولا تقتصر أهمية الاكتشاف على الجانب الطبي فقط، بل إنه يتحدى أيضًا افتراضات علمية قديمة كانت ترى أن الخلايا العرفية العصبية تؤدي أدوارًا بنيوية فقط في تكوين القلب، وأضافت الدكتورة ويزنياك: “توفر نتائجنا أن هذه الخلايا تعمل أيضًا كمراكز لإطلاق الإشارات، فهي لا تكتفي ببناء أجزاء من القلب، بل تُرشد الخلايا الأخرى إلى كيفية التصرف”.
آفاق مستقبلية للوقاية والعلاج
يأمل الباحثون أن يمهّد هذا العمل الطريق نحو تحسين التشخيص الجيني لأمراض القلب الخلقية، وعلى المدى البعيد قد يساهم في تطوير استراتيجيات تهدف إلى الوقاية من هذه العيوب أو تصحيحها قبل الولادة.